Cytomegalowirusowe zapalenie jelita grubego
Chłopiec, u którego w piętnastym miesiącu życia wykonano przeszczepienie wątroby od żywego dawcy. Powodem przeszczepienia wątroby była hepatoblastoma. Wkrótce po przeszczepieniu u pacjenta zaczęto obserwować biegunkę. Próby leczenia nifuroksazydem i bactrimem były nieskuteczne.
7 miesięcy po przeszczepie (w wieku 22 miesięcy) biegunka nasiliła się i pojawiło się krwawienie z dolnego odcinka przewodu pokarmowego. Dodatkowo wystąpiły stany gorączkowe, a w badaniach laboratoryjnych niedokrwistość (Hb-8,4 g/dl) i podwyższone stężenie CRP (5,82 mg/dl). Badania PCR wykazały obecność CMV (2810 kopii/ml) i EBV (7150 kopii/ml). Z posiewu stolca wyhodowano Campylobacter i zastosowano terapię azytromycyną, nie uzyskując poprawy. Wobec podejrzenia związku objawów klinicznych z zakażeniem CMV wykonano kolonoskopię z pobraniem materiału na badanie obecności wirusów w tkance. Badanie wykazało prawidłowy obraz jelita końcowego oraz obecność dość rozległego owrzodzenia na zastawce Bauhina (zdjęcie 1A) i niezbyt licznych, ale rozsianych na całej długości jelita aftowatych owrzodzeń zlokalizowanych na zapalnej podstawie otoczonych prawidłową błoną śluzową (zdjęcia 1B–C). Badanie patomorfologiczne wykazało niewielki stan zapalny z obecnością nieswoistej ziarniny zapalnej. W pobranych wycinkach jelita grubego stwierdzono obecność CMV-DNA, oraz wirusów HHV-6B i HHV-7.
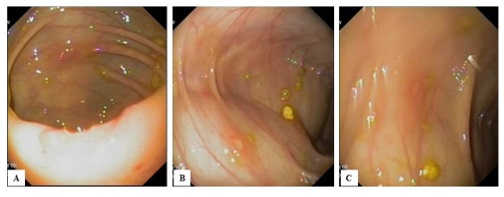
Zdjęcie 1. Obraz endoskopowy:
A – Kątnica – widoczne owrzodzenie na zastawce Bauhina.
B – Wstępnica – aftowate owrzodzenie.
C – Esica – aftowate owrzodzenie.
Zmodyfikowano immunosupresję i zastosowano leczenie gancyklowirem, uzyskując szybkie ustąpienie biegunki, obniżenie CRP, eliminacje CMV i znaczne obniżenie wiremii EBV. Pacjenta w stanie ogólnym dobrym wypisano do domu, zalecając kontynuowanie leczenia walgancyklowirem w warunkach ambulatoryjnych.
Komentarz:
Zakażenie CMV rzadko wywołuje objawy u osób z prawidłową odpornością, natomiast może stanowić istotny problem u osób z zaburzeniami odporności, w tym także u osób po transplantacjach narządowych otrzymujących leczenie immunosupresyjne (1). Zakażenie CMV może dotyczyć każdego z odcinków przewodu pokarmowego, ale najczęściej lokalizuje się w jelicie grubym, wywołując objawy zapalenia jelita grubego (2). Rzadszymi lokalizacjami infekcji CMV są dwunastnica, żołądek, przełyk i jelito cienkie.
Objawami zapalenia jelita grubego wywołanego zakażeniem CMV są biegunka, stany gorączkowe, bóle brzucha i krwawienia z dolnego odcinka przewodu pokarmowego. Objawy te są nietypowe i mogą sugerować inną niż wirusowa patologię jelita. Również obraz endoskopowy nie jest typowy. Najczęściej stwierdza się obecność mnogich owrzodzeń błony śluzowej, z których przynajmniej jedno ma większe rozmiary (3). Brak charakterystycznych zmian makroskopowych powoduje, że ustalenie możliwego związku pomiędzy zakażeniem CMV a zmianami chorobowymi w jelicie wymaga wykonania dodatkowych badań i wykrycia obecności wirusa w tkance. Badania te powinny być wykonane u pacjentów z zaburzeniami odporności prezentujących objawy choroby przewodu pokarmowego, w których krwi stwierdza się obecność CMV. Oprócz CMV w tkance często wykrywa się również inne wirusy z tej rodziny (np. HHV-B6).
W leczeniu objawów jelitowych wywołanych przez zakażenie CMV można stosować leki przeciwwirusowe, jednakże wiele prac wskazuje, że ma ono ograniczoną skuteczność a choroba przewodu pokarmowego ma tendencję do samoograniczania się (4, 5, 6).
U opisywanego pacjenta występowało wtórne do immunosupresji upośledzenie odporności, które sprzyjało zakażeniu CMV. We krwi pacjenta stwierdzano obecność przeciwciał antyCMV w klasie IgM oraz obecność CMV-DNA, występowały też objawy kliniczne sugerujące możliwość wtórnej do zakażenia CMV choroby jelita. Obecność CMV w tkance została potwierdzona dodatnim wynikiem badania, a objawy jelitowe ustąpiły po zmianie immunosupresji i włączeniu leczenia przeciwwirusowego. Dlatego wydaje się więc, że najprawdopodobniejszą przyczyną objawów i zmian na błonie śluzowej jelita grubego było zakażenie CMV.
Piśmiennictwo:
- Lemonovith T.L., Watkins R.R.: Update on cytomegalovirus infections of the gastrointestinal system in solid organ transplant recipients, [w:] „Current Infectious Disease Reports”, 2012, 14, ss.: 33–40.
- Koc B., Bircan H.Y., Altner S. i wsp.: Massive alimentary tract bleeding due to cytomegalovirus infection in elderly patients, [w:] „Infectious Disease Reports”, 2014, 6, ss.: 5512.
- Lin W.R., Su M.Y., Hsu C.M. i wsp.: Clinical and endoscopic features for alimentary tract cytomegalovirus disease: report of 20 cases with gastrointestinal CMV disease, [w:] „Chang Gung Medical Journal”, 2005, 7, ss.: 476–484.
- Maconi G., Lombardini M., Furfaro F. i wsp.: Long term outcome of inflammatory bowel diseases with cytomegalovirus colitis: effect of antiviral treatment, [w:] „European Journal of Gastroenterology & Hepatology”, 2014, 10, ss.: 1146–1151.
- Kopylov U., Eliakim-Raz N., Szilagy A. i wsp.: Antiviral therapy in cytomegalovirus-positive ulcerative colitis: a systematic review and metaanalysis, [w:] World Journal of Gastroenterology, 2014, 20, ss.: 2695–2793.
- Kim C.H., Bahng S., Kang K.J. i wsp.: Cytomegalovirus colitis in patients without inflammatory bowel disease: a single center study, [w:] „Scandinavian Journal of Gastroenterology”, 2010, 45, ss: 1295–1301.
Autorzy:
Instytut „Pomnik – Centrum Zdrowia Dziecka”: Agnieszka Bakuła, Beata Kasztelewicz, Marek Woynarowski
Listopad 2014
